Qui sommes-nous ?
LINCOLN est une société de Conseil qui aide les entreprises à valoriser leurs données. Nous associons des compétences techniques et fonctionnelles pour répondre aux problématiques de nos clients. Notre expérience permet de proposer des solutions sur mesure : du conseil sur des problématiques d’architecture, de gouvernance de la donnée, d’acculturation à la Data ou tout simplement de l’expertise sur un outil ou sur un sujet Data Driven.
Nos consultants sont des collaborateurs experts, passionnés et impliqués dans les projets Clients. Nous les plaçons au cœur de notre développement et ils permettent d’insuffler une belle dynamique au quotidien.
Merci à nos clients et futurs clients pour leur confiance !
Light Up Your Data

Donnons du sens à vos données
Spécialiste Data, LINCOLN a toujours placé l’analyse et le traitement de la donnée au cœur de son activité : collecter, orienter, analyser et visualiser la Data pour en extraire les connaissances et actions utiles à vos enjeux métiers.
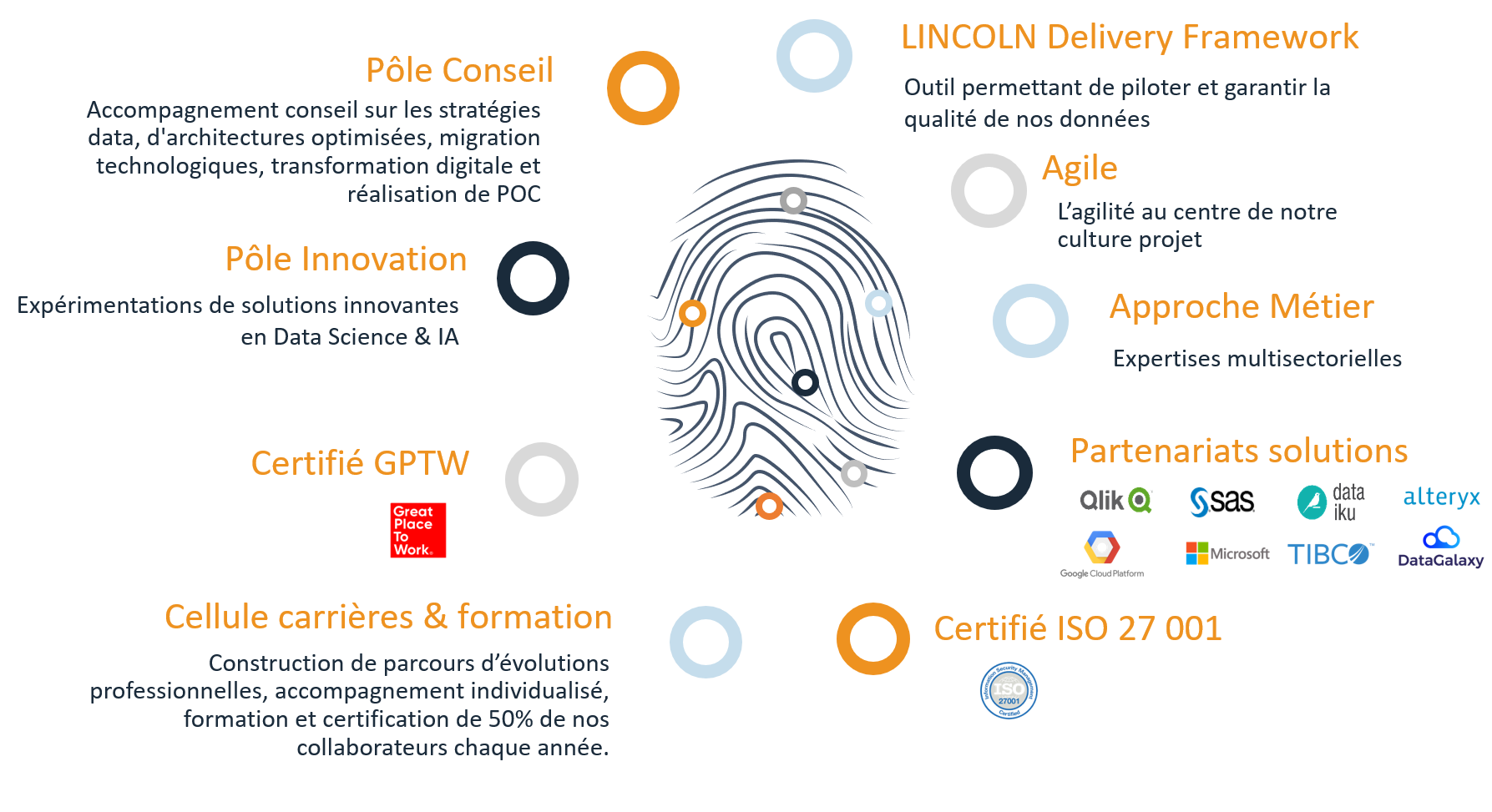
Nos atouts
Une approche 360° de la DATA, un savoir-faire spécifique, une structure orientée client, un accompagnement de nos collaborateurs font de LINCOLN le partenaire idéal pour l’analyse et le traitement de vos données.
LIGHT UP YOUR DATA
Lincoln en quelques dates
Si vous souhaitez en savoir plus à propos de Lincoln, n’hésitez pas à nous joindre à l’adresse hello@lincoln.fr,
par téléphone au +33 (0)1 46 08 70 73 ou via notre formulaire de contact :